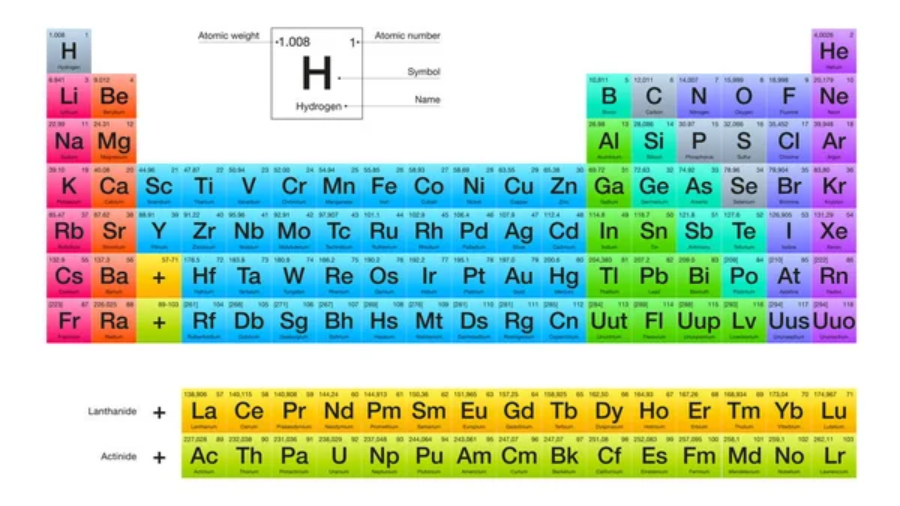
A tabela periódica é uma ferramenta fundamental na química para organizar e entender os elementos químicos. Ela é organizada em linhas horizontais chamadas períodos e colunas verticais chamadas grupos ou famílias:
História da Tabela Periódica
A história da tabela periódica remonta ao século XIX, com diversos químicos contribuindo para sua criação e desenvolvimento. Desde os trabalhos iniciais de Mendeleev e Meyer até os refinamentos modernos, a tabela passou por várias versões até se tornar o modelo que conhecemos hoje.
Tabela periódica de Mendeleev
Contexto Histórico
- Dmitri Mendeleev, um químico russo, propôs sua versão da tabela periódica em 1869.
- Ele organizou os elementos com base em suas propriedades químicas e físicas, observando padrões e tendências.
Organização por Massa Atômica
- Mendeleev organizou os elementos em ordem crescente de massa atômica.
- Ele deixou espaços vazios na tabela para elementos que ainda não haviam sido descobertos.
Períodos e Grupos
- Mendeleev organizou os elementos em fileiras horizontais (períodos) e colunas verticais (grupos).
- Os elementos em cada grupo compartilhavam propriedades químicas semelhantes.
- Ele identificou oito grupos na sua tabela periódica.
Preditividade
- Uma das contribuições mais significativas de Mendeleev foi sua capacidade de prever as propriedades de elementos ainda não conhecidos.
- Ele deixou espaços vazios na tabela para elementos que ele previu existirem e suas propriedades.
Limitações
- Embora a tabela de Mendeleev tenha sido um marco importante, ela tinha algumas limitações.
- Por exemplo, ele não conseguiu explicar completamente a variação irregular das propriedades dos elementos.
- Além disso, a tabela de Mendeleev não previa a existência de isótopos.
Impacto e Legado
- A tabela periódica de Mendeleev foi um marco na história da química, proporcionando uma estrutura organizada para os elementos químicos.
- Sua abordagem de previsão das propriedades de elementos desconhecidos demonstrou a utilidade e o poder da tabela periódica como uma ferramenta científica
Tabela periódica de Lothar Meyer
Contexto Histórico
- Lothar Meyer, um químico alemão, propôs sua versão da tabela periódica em 1864, independentemente de Mendeleev.
- Ele também organizou os elementos com base em suas propriedades químicas e físicas, observando padrões e tendências.
Organização por Volume Atômico
- Meyer organizou os elementos em ordem crescente de volume atômico.
- Ele notou que os elementos exibiam propriedades semelhantes em intervalos regulares de volume atômico.
Curva Periódica
- Meyer plotou os volumes atômicos dos elementos em um gráfico, o que resultou em uma curva periódica.
- Ele observou que a curva apresentava picos e vales que correspondiam a elementos com propriedades semelhantes.
Grupos e Períodos
- Assim como Mendeleev, Meyer organizou os elementos em grupos e períodos.
- Os elementos em cada grupo compartilhavam propriedades químicas semelhantes.
Legado
- O trabalho de Meyer contribuiu para a compreensão dos padrões e tendências dos elementos químicos.
- Sua abordagem de organização dos elementos por volume atômico ajudou a estabelecer as bases para o desenvolvimento posterior da tabela periódica.
Estrutura da Tabela Periódica
A tabela periódica é estruturada de forma a organizar os elementos de acordo com suas propriedades químicas e físicas. Os elementos são arranjados em ordem crescente de número atômico (número de prótons no núcleo do átomo).
Grupos ou Famílias
Os grupos, também chamados de famílias, são as colunas verticais na tabela periódica. Existem 18 grupos no total. Cada grupo possui elementos com propriedades químicas e comportamentos semelhantes devido ao fato de terem a mesma configuração eletrônica na camada de valência.
Períodos
Os períodos são as linhas horizontais na tabela periódica. Existem sete períodos no total. À medida que se move da esquerda para a direita em um período, o número de elétrons na camada de valência dos elementos aumenta, o que pode afetar suas propriedades químicas.
Propriedades Periódicas
As propriedades periódicas são características que variam periodicamente com o número atômico dos elementos. Elas incluem raio atômico, eletronegatividade, afinidade eletrônica, energia de ionização e condutividade elétrica, entre outras.
Blocos da Tabela Periódica
Os elementos na tabela periódica são divididos em blocos com base na configuração eletrônica de seus átomos. Os principais blocos são o bloco s, o bloco p, o bloco d e o bloco f.
Metais, Não-metais e Metaloides
Os elementos na tabela periódica podem ser classificados como metais, não-metais ou metaloides, com base em suas propriedades físicas e químicas. Os metais tendem a ser bons condutores de eletricidade e têm brilho metálico, enquanto os não-metais geralmente têm baixa condutividade elétrica e brilho opaco. Os metaloides possuem propriedades intermediárias entre metais e não-metais.
Metais
Os metais são um dos três principais grupos de elementos químicos encontrados na tabela periódica, ao lado dos não-metais e dos metaloides. Eles representam a maioria dos elementos na tabela periódica e compartilham várias propriedades físicas e químicas distintas. Aqui está uma explicação detalhada sobre os metais:
Propriedades Físicas dos Metais
- Brilho metálico: Os metais geralmente têm uma aparência brilhante e reflexiva quando polidos. Esse brilho é resultado da capacidade dos elétrons em absorver e reemitir a luz incidente.
- Condutividade elétrica: Os metais são excelentes condutores de eletricidade. Isso ocorre porque os elétrons em um metal são relativamente livres para mover-se através da estrutura cristalina do material.
- Condutividade térmica: Assim como conduzem eletricidade, os metais também conduzem calor muito bem.
- Maleabilidade: Os metais podem ser moldados e deformados sem quebrar. Isso é devido à estrutura cristalina dos metais, que permite que as camadas de átomos deslizem umas sobre as outras.
- Ductibilidade: Os metais podem ser esticados em fios finos sem quebrar. Isso ocorre porque os átomos de metal podem se mover uns sobre os outros sem romper as ligações metálicas.
Propriedades Químicas dos Metais
- Reatividade: Os metais tendem a perder elétrons facilmente, o que resulta em uma tendência a formar íons positivos (cátions) durante as reações químicas.
- Formação de óxidos básicos: Os metais tendem a formar óxidos básicos quando reagem com o oxigênio, o que significa que esses óxidos geralmente são solúveis em água e reagem com ácidos para formar sais e água.
- Eletropositividade: Os metais têm alta eletropositividade, o que significa que eles têm uma tendência a perder elétrons durante as reações químicas.
- Reatividade com ácidos: Alguns metais reagem com ácidos para liberar hidrogênio gasoso, formando sais metálicos e água.
Exemplos de Metais
- Metais Alcalinos: Lítio, Sódio, Potássio, Rubídio, Césio, Frâncio.
- Metais Alcalino-Terrosos: Berílio, Magnésio, Cálcio, Estrôncio, Bário, Rádio.
- Metais de Transição: Ferro, Cobre, Zinco, Níquel, Ouro, Prata.
- Metais de Bloco p: Alumínio, Chumbo, Estanho, Mercúrio.
Utilizações dos Metais
- Os metais têm uma ampla gama de aplicações em várias indústrias, incluindo construção, eletrônica, transporte, medicina, e muitos outros setores.
- Eles são usados em ligas metálicas para melhorar suas propriedades mecânicas e químicas, como resistência à corrosão, resistência mecânica, ou condutividade elétrica.
- Alguns metais são fundamentais na fabricação de produtos cotidianos, como utensílios de cozinha, fios elétricos, estruturas metálicas, e componentes de máquinas.
Ametais
Propriedades Físicas dos Ametais
- Ausência de Brilho Metálico: Ao contrário dos metais, os ametais geralmente não têm um brilho metálico característico quando polidos.
- Condutividade Elétrica e Térmica Baixa: Os ametais são geralmente maus condutores de eletricidade e calor. Isso ocorre porque eles não possuem elétrons livres em grande quantidade, como os metais.
- Estado Físico Variado: Os ametais podem existir em diferentes estados físicos à temperatura ambiente, incluindo sólidos, líquidos e gases.
Propriedades Químicas dos Ametais
- Eletronegatividade Alta: Os ametais tendem a atrair elétrons em uma ligação química, o que resulta em uma alta eletronegatividade. Isso significa que eles têm uma tendência a ganhar elétrons durante as reações químicas.
- Formação de Óxidos Ácidos: Quando reagem com o oxigênio, os ametais geralmente formam óxidos ácidos, que são solúveis em água e reagem com bases para formar sais e água.
- Reatividade Variada: A reatividade dos ametais pode variar significativamente. Alguns são altamente reativos, como o flúor, enquanto outros são menos reativos, como o carbono.
Exemplos de Ametais
- Hidrogênio: Embora seja geralmente classificado como um ametal, o hidrogênio também possui algumas características de um metal.
- Nitrogênio: Gás diatômico presente na atmosfera.
- Oxigênio: Importante para a respiração e a combustão.
- Flúor: O elemento mais eletronegativo e reativo.
- Carbono: A base de todas as formas de vida conhecidas.
- Fósforo: Encontrado em fosfatos importantes para os organismos vivos.
Utilizações dos Ametais
- Os ametais têm uma variedade de aplicações em diferentes campos, incluindo química, eletrônica, medicina, e muitos outros.
- Por exemplo, o oxigênio é essencial para a respiração e a combustão, enquanto o flúor é usado em uma variedade de produtos químicos e na produção de fluoretos.
- O carbono é um elemento chave em muitos compostos orgânicos, como proteínas, carboidratos, lipídios e ácidos nucleicos.
Metaloides
Propriedades Físicas dos Metaloides
- Condutores Parciais: Os metaloides têm uma condutividade elétrica que é intermediária entre a dos metais e dos não-metais. Alguns, como o silício, podem conduzir eletricidade sob certas condições, enquanto outros, como o germânio, têm uma condutividade ainda menor.
- Brilho Variável: Dependendo das condições, alguns metaloides podem exibir um brilho metálico, enquanto outros podem ser opacos.
- Variedade de Estados Físicos: Os metaloides podem existir em diferentes estados físicos à temperatura ambiente, incluindo sólidos (como silício e germânio) e líquidos (como o bromo).
Propriedades Químicas dos Metaloides
- Semicondutores: Muitos metaloides têm propriedades semicondutoras, o que os torna essenciais na fabricação de dispositivos eletrônicos, como chips de computador e diodos.
- Variação na Eletronegatividade: Os metaloides exibem uma ampla gama de eletronegatividades, com alguns sendo mais metálicos e outros mais não-metálicos.
- Formação de Óxidos Anfóteros: Alguns metaloides, como o silício e o alumínio, podem formar óxidos que exibem tanto propriedades ácidas quanto básicas. Chama-se esses óxidos de óxidos anfóteros.
Exemplos de Metaloides
- Silício: É um elemento crucial na fabricação de chips de computador e outros dispositivos eletrônicos.
- Arsênio: Utiliza-se em pesticidas e semicondutores.
- Boro: Utiliza-se em fibras de vidro, cerâmicas e produtos químicos.
- Germânio: Tem aplicações em semicondutores e detectores de radiação.
- Antimônio: Utiliza-se em ligas metálicas e na fabricação de semicondutores.
- Telúrio: Utiliza-se em ligas metálicas e na fabricação de células solares.
Utilizações dos Metaloides
- Utiliza-se os metaloides em uma variedade de aplicações industriais, incluindo eletrônicos, materiais de construção, medicina, e muitos outros.
- Por exemplo, o silício é um componente essencial dos chips de computador e outros dispositivos eletrônicos.
- Utiliza-se o boro em produtos químicos, cerâmicas, e até mesmo em alguns tratamentos médicos.
- Utiliza-se o arsênio em pesticidas, semicondutores e em medicina.
Elementos Transurânicos
Além dos elementos que encontram-se naturalmente na natureza, também inclui-se a tabela periódica elementos transurânicos, que são elementos sintéticos produzidos em laboratório e têm números atômicos superiores a 92.
Aplicações da Tabela Periódica
A tabela periódica é uma ferramenta crucial para os químicos em diversas áreas, incluindo síntese de compostos, análise de materiais, previsão de comportamento químico e estudo da estrutura atômica.